LS6.2 Oberflächenbearbeitung von Modellgussprothesen
Elektrolytisches Glänzen
Die notwendigen Kompetenzen zur Oberflächenbearbeitung zahntechnischer Werkstücke mit rotierenden Instrumenten hast Du schon in der LS4.4 (Oberflächenbearbeitung von Interimsprothesen) erworben. Zusätzlich dazu, bzw. eher davor hast Du bei Modellgussprothesen die Möglichkeit, durch das Elektrolytisches Glänzen viel Zeit zu sparen!
Das elektrolytische Glänzen (Elektrolyse in Wikipedia) ist ein Vorgang zur Oberflächenbearbeitung, der in der Modellgusstechnik für Partielle Prothesen aus CoCr-Legierungen verwendet wird. (Anleitung für ein Glänzgerät der Firma BEGO)
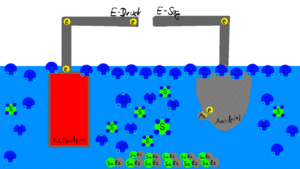
Die gegossene, ausgebettete und abgestrahlte Prothese bzw. das Prothesengerüst wird in das elektrolytischen Glänzbad gehängt. Das Gerät wird für eine bestimmte Zeit eingeschaltet. Nun fließt Strom durch den Elektrolyten, der die Spitzen des Rauhigkeitsprofils der Oberfläche des Objektes ganz langsam abträgt. Anschließend ist es glatter (hat also eine geringere Rauigkeit) und glänzt! Das ist bei so einem komplexen Objekt viel einfacher und gleichmäßiger, als das Ausarbeiten mit Fräsen oder Schleifwerkzeugen.
Elektrolytisches Glänzen funktioniert nicht nur mit Modellgussprothesen sondern auch bei der Schmuckherstellung:
Bevor du verstehen kannst, was da im Glänzbad läuft, musst du dir mal wieder Wissen im Bereich "Chemie", speziell der Protolyse, aneignen. Diese Protolyse macht der Hersteller des Elektrolyten, bevor Du den Kanister mit der Flüssigkeit kaufst. Der Elektrolyt verbraucht sich nämlich und muss regelmäßig ausgetauscht werden, dazu aber später mehr.
Arbeitsauftrag 1:
Folge dem Link LS6.2 Protolyse und erledige den dort hinterlegten Arbeitsauftrag.
Prinzipiell passiert in einem Glänzbad folgendes:
Durch eine von außen angelegte elektrische Spannung (Gleichstrom) wird an einer mit dem Pluspol verbundenen Elektrode (unser Werkstück, die Modellgussprothese, in Abbildung rechts) ein Elektronenmangel ("Elektronensog") und einer mit dem Minuspol verbundenen Elektrode (Kupferplatten im Glänzbad, in Abbildung links) ein Elektronenüberschuss ("Elektronendruck") erzeugt. Die elektrochemische Oxidation erfolgt an der Anode und besteht in einem Elektronenentzug durch die Stromquelle: Die Anode ist bei der Elektrolyse die positiv geladene Elektrode (Pluspol), die Kathode die negativ geladene Elektrode (Minuspol).
Damit der Vorgang dauerhaft abläuft, muss ständig Energie zugeführt werden. Dies geschieht in Form von elektrischem Gleichstrom, der der Anode ständig Elektronen entzieht (absaugt) und sie zur Kathode "pumpt".
Damit der Stromkreis geschlossen bleibt, muss im Elektrolyten ebenfalls Strom fließen. Hier wird der Ladungstransport durch Ionen erledigt: Die negativ geladenen Anionen sind in unserem Beispiel der Säurerest im Elektrolyten, sie wandern bevorzugt zur positiv geladenen Anode. Die positiv geladenen Kationen, hier Oxonium-Ionen, wandern zur negativ geladenen Kathode.
An der Kathode erhält das Oxonium-Ion sein fehlendes Elektron zurück und steigen als Wasserstoffgas auf. Der Rest bleibt als Wasser zurück. An der Anode verbindet sich ein Säurerest mit einem Metallion aus der Oberfläche des dort befestigten Werkstücks. Sie bilden zusammen ein Salz, dass sich als Schlamm am Boden des Beckens sammelt. Durch das Entfernen der Metallionen aus dem Werkstück, bevorzugt von erhabenen Stellen der Oberfläche, wird dieses glatter und glänzt!
Die Ionen des Elektrolyten werden also verbraucht. Das erklärt die nachlassende Wirkung des Glänzbades und die Notwendigkeit des Austauschens des Glänzbades von Zeit zu Zeit.
Lernvideo mit Animationen und Erklärungen:
Einzelne Bilder der Animationen
Dieses kurze Video beschreibt einen Unterrichtsversuch mit einem alten Glänzgerät, einer Modellgussprothese, einem Kupferstab und einer wässrigen Lösung mit Essigsäure.
Arbeitsauftrag 2
- Level 1: Erledige die beiden interaktiven Übungen zum Glänzen im Moodle-Kurs (Lernmanagmentsystem).
- Level 2: Erläutere mit eigenen Worten und einer Skizze den Ablauf im Glänzbad im Video zum Unterrichtsversuch. Die dort verwendete Essigsäure hat die Summenformel C2H4O2. Verwende bei der Erläuterung chemische Formeln und Fachbegriffe.
- Level 3: Das Glänzbad in deinem Labor funktioniert nicht mehr richtig! Du versuchst, bei voller Stromstärke und maximaler Zeiteinstellung, eine Modellgussprothese zu glänzen, aber es passiert fast nichts auf der Oberfläche! Die Elektrolyt-Brühe sieht ziemlich dunkel aus ...
- Level 4: Ändere den Aufbau des Glänzbades so, dass nicht Material abgetragen sondern aufgetragen wird! (Das geschieht z.B. beim elektrochemischen Vergolden von Werkstücken oder in der Galvanotechnik).
- Lass Dich dabei gern von einer KI unterstützen. Dokumentiere sowohl den Prompt als auch das Ergebnis.
- Verfasse die Erklärung auf jeden Fall in eigenen Worten. Überlege, ob die Antwort der KI plausibel ist.
Gib alle Ergebnisse im Moodlekurs Lernmanagementsystem ab! Du muss auch die niedrigeren Level bearbeiten!